Dược Phẩm Mộc Lâm xin dịch bài phỏng vấn của Grace Liu từ Sino Biological chia sẻ chuyên môn của cô về Liên hợp thuốc kháng thể (ADC), một liệu pháp điều trị ung thư mang tính cách mạng kết hợp nhắm mục tiêu chính xác với các loại thuốc gây độc tế bào mạnh. Với nền tảng vững chắc về khoa học y tế và liệu pháp miễn dịch , Grace nêu bật khoa học, thách thức và đổi mới thúc đẩy sự phát triển của ADC và vai trò của Sino Biological trong việc thúc đẩy lĩnh vực chuyển đổi này.
Bạn có thể giới thiệu bản thân và cho chúng tôi biết đôi chút về lý lịch của bạn không?
Tôi tên là Grace Liu. Tôi gia nhập Sino Biological vào năm 2022 để hỗ trợ các dịch vụ CRO và quản lý các dự án trên khắp các khu vực miền Tây và miền Trung Hoa Kỳ. Tôi đã lấy bằng Tiến sĩ Khoa học Y khoa tại Baylor College of Medicine ở Houston, Texas.
Trước khi gia nhập Sino Biological, tôi đã làm nghiên cứu sinh sau tiến sĩ tại Viện nghiên cứu Houston Methodist, nơi tôi tập trung vào việc phát triển các thiết bị giải phóng thuốc bền vững cho liệu pháp miễn dịch ung thư.
Bạn có thể giải thích ADC là gì không?
Các liên hợp kháng thể-thuốc (ADC) là một phương thức điều trị ung thư đầy hứa hẹn được thiết kế để đưa các tác nhân gây độc tế bào cực mạnh trực tiếp vào tế bào khối u. Phương pháp này tối đa hóa hiệu quả điều trị đồng thời giảm thiểu độc tính toàn thân.
Cửa sổ điều trị hẹp thường hạn chế hóa trị ung thư thông thường do thiếu tính đặc hiệu đối với tế bào khối u. Do đó, các tác nhân hóa trị thường gây hại cho các tế bào bình thường với tỷ lệ phân bào cao, dẫn đến nhiều tác dụng phụ. Do đó, có nhu cầu cấp thiết đối với các lựa chọn điều trị có chọn lọc hơn.
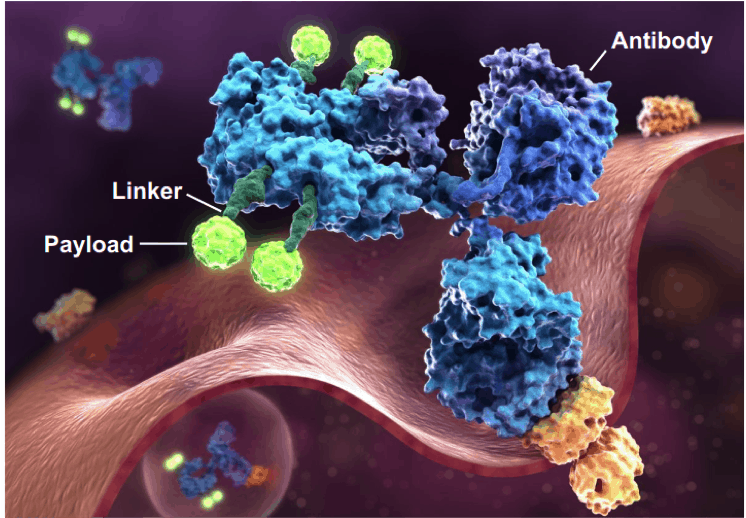
Được gọi là “viên đạn ma thuật”, ADC bao gồm một kháng thể đơn dòng (mAb) đóng vai trò là chất mang liên hợp với thuốc gây độc tế bào (được gọi là tải trọng) thông qua một chất liên kết hóa học. ADC tận dụng tính đặc hiệu của mAb đối với kháng nguyên liên quan đến khối u để đạt được mục tiêu phân phối thuốc gây độc tế bào đến các tế bào khối u.
Khi một ADC liên kết với kháng nguyên mục tiêu của nó trên tế bào khối u, phức hợp ADC-kháng nguyên trải qua quá trình nội bào hóa thông qua thụ thể trung gian vào một nội bào sớm. Nội bào sau đó trưởng thành và hợp nhất với một lysosome. ADC giải phóng tải trọng của nó bên trong lysosome, trở thành một loại thuốc không có hoạt tính khuếch tán vào tế bào chất. Thuốc có hoạt tính này phát huy tác dụng gây độc tế bào, cuối cùng dẫn đến chết tế bào.
Các thành phần chính của ADC là gì?
ADC có ba thành phần chính: xương sống kháng thể đơn dòng (mAb), tải trọng tế bào độc và liên kết. Việc tạo ra ADC không chỉ là sự kết hợp đơn giản, mà thách thức chính là sự cân bằng giữa hiệu quả và tính an toàn.
mAb đóng vai trò gì trong liệu pháp ADC?
Hoạt động như phương tiện nhắm mục tiêu khối u, thành phần mAb của ADC phải có tính đặc hiệu kháng nguyên cao, ái lực liên kết kháng nguyên mạnh và khả năng nội hóa hiệu quả, cùng với các đặc tính khác. Các mAb nhận diện được các kháng nguyên chủ yếu được biểu hiện quá mức trên bề mặt tế bào khối u được ưu tiên sử dụng cho ADC, đảm bảo phân phối tải trọng đặc hiệu cho khối u và có cửa sổ điều trị rộng.
Các kháng nguyên mục tiêu của ADC được chấp thuận bao gồm HER2 , TROP2 , Nectin-4 , EGFR , TF và FRα đối với khối u rắn và CD19 , CD22 , CD33 , CD30 , BCMA và CD79b đối với các bệnh ác tính về huyết học. Hiệu quả nội hóa rất quan trọng đối với hiệu quả của ADC.
Độ ái lực liên kết kháng nguyên cao hơn thường thúc đẩy quá trình nội hóa nhanh, nhưng liên kết quá mạnh có thể cản trở sự thâm nhập của ADC vào khối u rắn, một hiện tượng được gọi là hiệu ứng rào cản vị trí liên kết. Do đó, cần cân bằng cẩn thận các thông số khác nhau để tối ưu hóa thiết kế mAb.
Các đặc điểm mong muốn của phần kháng thể bao gồm khả năng sinh miễn dịch tối thiểu và thời gian bán hủy lưu thông dài. Các kháng thể được nhân hóa và hoàn toàn của con người, ít sinh miễn dịch hơn các mAb ở chuột hoặc chimeric, thường được sử dụng làm xương sống ADC. Phân nhóm IgG1 được ưa chuộng vì chức năng tác động mạnh và tính ổn định trong lưu thông toàn thân, với thời gian bán hủy là 21 ngày.
Vai trò của chất liên kết trong ADC là gì?
Chất liên kết kết nối tải trọng gây độc tế bào với mAb. Nó có hai mục đích chính: đảm bảo sự ổn định trong huyết tương để ngăn ngừa giải phóng thuốc sớm và cho phép giải phóng hiệu quả tải trọng khi nội hóa bên trong tế bào khối u.
Hiện nay, các liên kết được phân loại thành hai loại: có thể phân cắt và không thể phân cắt. Các liên kết có thể phân cắt được thiết kế để phân hủy để đáp ứng với các yếu tố liên quan đến khối u và bao gồm các liên kết không bền với axit (ví dụ, hydrazone), các liên kết có thể khử/nhạy cảm với glutathione (ví dụ, disulfide) và các liên kết nhạy cảm với protease/peptide (ví dụ, dipeptide valine–citrulline).
Các liên kết không thể phân cắt dựa vào sự phân hủy hoàn toàn của mAb trong lysosome, giải phóng chất độc liên kết với một dư lượng axit amin (thường là cysteine hoặc lysine) từ mAb bị phân hủy.
Các liên kết không thể phân cắt cung cấp độ ổn định huyết tương cao hơn và giảm độc tính ngoài mục tiêu nhưng có thể hạn chế tải trọng đối với những tải trọng có hiệu quả bất chấp sự biến đổi hóa học. Các liên kết có thể phân cắt cho phép giải phóng tải trọng hiệu quả và được kiểm soát và tương thích với nhiều loại thuốc hơn, nhưng tính linh hoạt của chúng làm tăng nguy cơ giải phóng thuốc sớm và độc tính toàn thân.
Thiết kế cẩn thận là điều cần thiết để cân bằng độ ổn định của liên kết và hiệu quả giải phóng tải trọng. Hầu hết các loại thuốc được chấp thuận và gần như tất cả các ADC trong các thử nghiệm lâm sàng đều sử dụng các liên kết có thể phân cắt, đặc biệt là các liên kết có thể phân cắt bằng enzyme.
Chức năng của tải trọng trong ADC là gì?
Tải trọng là thành phần tác động của ADC, thường là thuốc gây độc tế bào có hiệu lực cao với giá trị nồng độ ức chế tối đa một nửa (IC50) ở mức dưới nanomolar hoặc picomolar, so với IC50 micromolar của thuốc hóa trị liệu thông thường.
Hiệu lực cao là điều cần thiết vì chỉ có khoảng 2% liều ADC được sử dụng đến được vị trí khối u và mAb chỉ có thể mang một số lượng hạn chế các phân tử tải trọng.
Tải trọng ADC hiện tại được chia thành hai loại: chất ức chế tubulin và tác nhân gây tổn thương DNA. Chất ức chế tubulin, chẳng hạn như auristatin (ví dụ, MMAE và MMAF) và maytansinoid (ví dụ, DM1 và DM4), phá vỡ quá trình lắp ráp vi ống, gây ra sự ngừng phân bào và chết tế bào.
Các tác nhân gây tổn hại DNA bao gồm calicheamicin, gây đứt gãy chuỗi kép; pyrrolobenzodiazepin (PBD), tạo ra liên kết chéo DNA; duocarmycin, gây ra quá trình alkyl hóa DNA; và camptothecin (ví dụ, DXd và SN-38), ức chế topoisomerase I, dẫn đến đứt gãy DNA.
Các tải trọng mới nổi bao gồm các chất kích thích miễn dịch (ví dụ, chất chủ vận STING và chất chủ vận TLR) và các tế bào lai nhắm mục tiêu phân giải protein (PROTAC).
Tỷ lệ thuốc trên kháng thể (DAR), biểu thị số lượng trung bình các phân tử tải trọng gắn vào mỗi mAb, là một thông số quan trọng đối với thiết kế ADC. Trong khi các giá trị DAR cao hơn có thể làm tăng hiệu lực, chúng cũng có thể dẫn đến tình trạng kỵ nước quá mức, dẫn đến kết tụ kháng thể, tăng tốc độ thanh thải và độc tính.
Tối ưu hóa DAR là điều cần thiết để cân bằng hiệu quả và an toàn. Các đặc điểm tải trọng quan trọng khác bao gồm khả năng tương thích liên hợp, độ hòa tan trong nước và độ ổn định dưới dạng liên hợp.
Tại sao ADC lại được chú ý trong chăm sóc sức khỏe?
Các liên hợp kháng thể-thuốc (ADC) đại diện cho một bước đột phá trong kỷ nguyên của liệu pháp nhắm mục tiêu, mang lại tiềm năng đáng kể để đáp ứng nhu cầu ngày càng tăng về hiệu quả và tính an toàn được nâng cao trong điều trị ung thư. ADC được thiết kế như một dạng “hóa trị liệu nhắm mục tiêu”, kết hợp hiệu lực của các tác nhân hóa trị liệu với tính đặc hiệu của kháng thể đơn dòng (mAb) để hướng tác động điều trị đến các tế bào khối u.
Phương pháp cung cấp thuốc có mục tiêu này đã thu hút được sự chú ý rộng rãi do những lợi ích lâm sàng và ưu điểm đáng kể so với phương pháp hóa trị thông thường.
Ví dụ, ADC có khả năng cải thiện tỷ lệ đáp ứng khách quan và độ bền của phản ứng ở cả khối u lỏng và rắn, cho dù được sử dụng như liệu pháp đơn trị hay kết hợp với liệu pháp hóa trị hoặc thuốc ức chế điểm kiểm soát miễn dịch.
Ngoài ra, khi y học cá nhân hóa phát triển và được hưởng lợi từ dữ liệu cá nhân hóa mở rộng, các ADC có khả năng nhắm mục tiêu vào các phân nhóm ung thư cụ thể có thể trở thành công cụ ngày càng mạnh mẽ trong cuộc chiến chống lại ung thư.
Mặc dù có triển vọng, ADC vẫn phải đối mặt với nhiều thách thức. Bao gồm khó khăn trong việc lựa chọn và xác nhận kháng nguyên mục tiêu thích hợp, sự phức tạp trong thiết kế, quá trình phát triển và sản xuất tốn kém và mất nhiều thời gian, cùng các vấn đề kỹ thuật như độ ổn định của liên kết, tính không đồng nhất của ADC, độc tính và khả năng kháng thuốc.
Việc phát triển các ADC hiệu quả và an toàn hơn đòi hỏi phải tối ưu hóa kháng thể, thiết kế các liên kết mạnh mẽ, tinh chỉnh hóa học liên hợp và lựa chọn các lớp tải trọng phù hợp. Hơn nữa, hiểu biết sâu hơn về sinh học ung thư và bối cảnh của các mục tiêu tiềm năng là rất quan trọng.
Những nỗ lực đáng kể đang được tiến hành để vượt qua những trở ngại này. Bản chất mục tiêu, hiệu quả, cách tiếp cận cá nhân hóa, tiềm năng đổi mới và cơ hội thị trường đáng kể của ADC, kết hợp với phạm vi cải tiến hơn nữa, khiến chúng trở thành trọng tâm hấp dẫn của nghiên cứu và phát triển. Điều này đã thu hút sự chú ý đáng kể từ nhiều bên liên quan trong lĩnh vực chăm sóc sức khỏe.
Tình trạng hiện tại của ADC trong điều trị là gì?
Năm 2000, gemtuzumab ozogamicin (Mylotarg ® ) trở thành thuốc liên hợp kháng thể (ADC) đầu tiên được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận để điều trị bệnh bạch cầu tủy cấp tính.
Tính đến tháng 4 năm 2024, 13 ADC đã được chấp thuận lâm sàng trên toàn thế giới để điều trị nhiều loại bệnh ác tính về huyết học và khối u rắn. Ngoài ra, hơn 100 ADC hiện đang được đánh giá trong các thử nghiệm lâm sàng cho nhiều loại ung thư hơn, với nhiều loại cho thấy thành công đáng kể trong giai đoạn phát triển tiên tiến. 2
Bảng 1. Các ADC được chấp thuận trên toàn thế giới. 1 Nguồn: Sino Biological Inc.
| ADC | Nhà phát triển | Mục tiêu | Tải trọng | Chỉ định | Năm được chấp thuận |
|---|---|---|---|---|---|
| Elahere ® (mirvetuximab soravtansine) | ImmunoGen (AbbVie) | FRα | DM4 | Ung thư buồng trứng, ống dẫn trứng và phúc mạc | 2022 |
| Tivdak ® (tisotumab vedotin) | Seagen (Pfizer) | Yếu tố mô (TF) | Võ thuật hỗn hợp | Ung thư cổ tử cung | 2021 |
| Zynlonta ® (loncastuximab tesirine) | Liệu pháp ADC | CD19 | SG3199 | Tiền thân của bệnh bạch cầu tế bào B lớn | 2021 |
| Trodelvy ® (sacituzumab govitecan) | Khoa học Gilead | TROP2 | SN-38 | Ung thư vú ba âm tính và ung thư biểu mô niệu quản | 2020 |
| Enhertu ® (fam-trastuzumab deruxtecan) | Daiichi Sankyo, AstraZeneca | HER2 | ĐXd | Ung thư vú HER2 dương tính, ung thư phổi không phải tế bào nhỏ, ung thư dạ dày và thực quản | 2019 |
| Padcev ® (enfortumab vedotin) | Astellas, Seagen | Nectin-4 | Võ thuật hỗn hợp | Ung thư biểu mô niệu quản di căn | 2019 |
| Polivy ® (polatuzumab vedotin) | Roche | CD79b | Võ thuật hỗn hợp | U lympho tế bào B lớn lan tỏa | 2019 |
| Besponsa ® (inotuzumab ozogamicin) | Công ty Pfizer | CD22 | Thuốc Calichamicin | Tiền thân tế bào B dương tính với CD22 u lympho bào cấp tính | 2017 |
| Kadcyla ® (ado-trastuzumab emtansine) | Roche | HER2 | DM1 | Ung thư vú di căn HER2 dương tính | 2013 |
| Adcetris ® (brentuximab vedotin) | Takeda, Seagen | CD30 | Võ thuật hỗn hợp | U lympho Hodgkin, u lympho tế bào lớn anaplastic | 2011 |
| Mylotarg ® (gemtuzumab ozogamicin) | Công ty Pfizer | CD33 | Thuốc Calichamicin | Bệnh bạch cầu tủy cấp tính | 2000 (tái khởi chạy năm 2017) |
| Lumoxiti ® (moxetumomab pasudotox) | AstraZeneca | CD22 | PE38 | Bệnh bạch cầu tế bào lông | 2018 (rút lại vào giữa năm 2023) |
| Blenrep ® (belantamab mafodotin) | GSK | BCMA | Võ thuật hỗn hợp | Bệnh đa u tủy | 2020 (rút lại 2022) |
| Akalux ® (cetuximab sarotalocan) | Rakuten Y tế | EGFR | Máy ảnh IRDYe 700DX | Ung thư đầu và cổ | 2020 (tại Nhật Bản) |
| Aidixi ® (disitamab vedotin) | RemeGen | HER2 | Võ thuật hỗn hợp | Ung thư biểu mô tiết niệu và dạ dày | 2021 (tại Trung Quốc) |
Bất chấp những thành tựu này và triển vọng đầy hứa hẹn, lĩnh vực này vẫn phải đối mặt với những thách thức đáng kể, bao gồm giải quyết tính không đồng nhất của khối u, khắc phục tình trạng kháng thuốc và giảm thiểu tác dụng phụ liên quan đến điều trị.
Sự tiến bộ trong công nghệ ADC và hiểu biết sâu sắc hơn về cơ chế ADC là những yếu tố chính thúc đẩy sự phát triển của ADC thế hệ tiếp theo với khả năng nhắm mục tiêu được cải thiện, hiệu lực cao hơn và hồ sơ an toàn được nâng cao.
Một lĩnh vực đổi mới trong ADC thế hệ tiếp theo là phát triển ADC bispecific, được phân loại thành hai loại dựa trên cơ chế hoạt động của chúng. Loại đầu tiên bao gồm ADC bispecific nhắm vào hai kháng nguyên khác nhau, một phương pháp được thiết kế để cải thiện tính chọn lọc đối với tế bào khối u so với mô bình thường và tiêu diệt phổ tế bào khối u rộng hơn khi các kháng nguyên mục tiêu được biểu hiện không đồng nhất trong khối u.
Loại thứ hai liên quan đến ADC lưỡng tính, nhận diện hai epitope riêng biệt của cùng một kháng nguyên. Chiến lược này nhằm mục đích tăng cường quá trình nội hóa và vận chuyển của ADC đến lysosome, do đó tối đa hóa việc đưa chất gây độc tế bào vào tế bào khối u.
Ngoài ung thư, ngày càng có nhiều sự quan tâm đến việc áp dụng ADC cho các bệnh không liên quan đến ung thư, chẳng hạn như các rối loạn tự miễn dịch và nhiễm trùng do vi khuẩn. Ví dụ, kháng thể liên hợp với các tác nhân chống viêm như glucocorticoid cho phép phân phối thuốc có chọn lọc đến các tế bào miễn dịch được kích hoạt.
Phương pháp này làm giảm phản ứng viêm trong khi giảm thiểu tác dụng phụ, mang lại tiềm năng trong điều trị các bệnh viêm. Tương tự như vậy, liên hợp kháng thể-kháng sinh (AAC) đang được phát triển để loại bỏ hiệu quả vi khuẩn nội bào, đại diện cho một nền tảng điều trị đầy hứa hẹn để tăng cường hiệu quả kháng sinh chống lại các bệnh nhiễm trùng do vi khuẩn khó điều trị.
Sino Biological có vai trò gì trong việc thúc đẩy phát triển ADC?
Phát triển liên hợp kháng thể-thuốc (ADC) là một quá trình phức tạp đòi hỏi phải cân nhắc cẩn thận một số yếu tố, bao gồm mục tiêu, kháng thể, tải trọng và chất liên kết. Ngoài ra, do tính đa dạng và phức tạp về cấu trúc, ADC phải đối mặt với những thách thức riêng về công thức, sản xuất và kiểm soát chất lượng.
Là nhà cung cấp hàng đầu trong ngành dược phẩm, Sino Biological đóng vai trò then chốt trong mọi khía cạnh quan trọng của quá trình phát triển ADC. Công ty cung cấp các giải pháp phát triển ADC toàn diện phù hợp với nhu cầu cụ thể của các công ty dược phẩm và công nghệ sinh học.
Các giải pháp này bao trùm toàn bộ hành trình phát triển, từ khám phá ban đầu đến nghiên cứu lâm sàng (Hình 1). Các dịch vụ của Sino Biological được thiết kế để giúp khách hàng đẩy nhanh tiến độ trong suốt quá trình phát triển ADC.

Hình 1. Các giải pháp phát triển ADC tại Sino Biological. Tín dụng hình ảnh: Sino Biological Inc.
Tài liệu tham khảo
- Senior, M. (2024). Các hợp chất liên hợp thuốc kháng thể nhắm mục tiêu ung thư thúc đẩy cơn sốt giao dịch. Nature Biotechnology , [trực tuyến] trang 1–5. https://doi.org/10.1038/s41587-024-02168-5 .
- Tsuchikama, K., et al . (2024). Khám phá thế hệ tiếp theo của liên hợp kháng thể-thuốc. Nature Reviews Clinical Oncology , [trực tuyến] trang 1–21. https://doi.org/10.1038/s41571-023-00850-2 .
Về Grace Liu
Grace Liu gia nhập Sino Biological vào năm 2022, hỗ trợ các dịch vụ CRO và quản lý dự án tại các khu vực miền tây và miền trung Hoa Kỳ. Grace nhận bằng Tiến sĩ Khoa học Y khoa từ Cao đẳng Y khoa Baylor ở Houston (TX, Hoa Kỳ). Trước khi gia nhập Sino Biological, cô đã làm việc tại Viện Nghiên cứu Houston Methodist (TX, Hoa Kỳ) với tư cách là nghiên cứu sinh sau tiến sĩ tập trung vào các thiết bị giải phóng thuốc bền vững cho liệu pháp miễn dịch ung thư. Trong cuộc phỏng vấn này, Grace thảo luận về cách các dấu ấn sinh học đóng vai trò quan trọng trong việc phòng ngừa và chẩn đoán ung thư , và cách chúng có thể giúp hướng dẫn các quyết định điều trị.
Giới thiệu về Sino Biological Inc. Sino Biological là nhà cung cấp thuốc thử và dịch vụ quốc tế. Công ty chuyên sản xuất protein tái tổ hợp và phát triển kháng thể. Tất cả các sản phẩm của Sino Biological đều được phát triển và sản xuất độc lập, bao gồm protein tái tổ hợp, kháng thể và bản sao cDNA. Sino Biological là cửa hàng dịch vụ kỹ thuật một cửa của các nhà nghiên cứu về các nền tảng công nghệ tiên tiến mà họ cần để tạo ra những tiến bộ. Ngoài ra, Sino Biological cung cấp cho các công ty dược phẩm và công ty công nghệ sinh học các dịch vụ công nghệ sản xuất tiền lâm sàng cho hàng trăm ứng cử viên thuốc kháng thể đơn dòng.
Sino Biological là nhà cung cấp thuốc thử và dịch vụ quốc tế. Công ty chuyên sản xuất protein tái tổ hợp và phát triển kháng thể. Tất cả các sản phẩm của Sino Biological đều được phát triển và sản xuất độc lập, bao gồm protein tái tổ hợp, kháng thể và bản sao cDNA. Sino Biological là cửa hàng dịch vụ kỹ thuật một cửa của các nhà nghiên cứu về các nền tảng công nghệ tiên tiến mà họ cần để tạo ra những tiến bộ. Ngoài ra, Sino Biological cung cấp cho các công ty dược phẩm và công ty công nghệ sinh học các dịch vụ công nghệ sản xuất tiền lâm sàng cho hàng trăm ứng cử viên thuốc kháng thể đơn dòng.
Hoạt động kinh doanh cốt lõi của Sino Biological
Sino Biological cam kết cung cấp các thuốc thử protein và kháng thể tái tổ hợp chất lượng cao và trở thành cửa hàng dịch vụ kỹ thuật trọn gói cho các nhà nghiên cứu khoa học sự sống trên toàn thế giới. Tất cả các sản phẩm của chúng tôi đều được phát triển và sản xuất độc lập. Ngoài ra, chúng tôi cung cấp cho các công ty dược phẩm và công ty công nghệ sinh học các dịch vụ công nghệ sản xuất tiền lâm sàng cho hàng trăm ứng cử viên thuốc kháng thể đơn dòng. Các chỉ số kiểm soát chất lượng sản phẩm của chúng tôi đáp ứng các yêu cầu nghiêm ngặt đối với các mẫu sử dụng lâm sàng. Chúng tôi chỉ mất vài tuần để sản xuất 1 đến 30 gam kháng thể đơn dòng tinh khiết từ giải trình tự gen.
Bài viết được đăng tải bởi Công Ty TNHH Thương Mại và Dược Phẩm MỘC LÂM ( MỘCLÂMPHARMA ) chuyên nhập khẩu và phân phối các sản phẩm thuốc, thiết bị y tế, thực phẩm bảo vệ sức khỏe. Công ty ưu tiên các sản phẩm chất lượng cao, ứng dụng nghiên cứu tiên phong của các công ty dược phẩm trong nước nhằm mang đến mức giá tối ưu cho Cộng đồng. Bên cạnh đó MỘC LÂM PHARMA cũng đặt trọng tâm hợp tác với các đối tác có lịch sử phát triển lâu đời dẫn đầu thế giới trong lĩnh vực dược phẩm, các trung tâm nghiên cứu tuân thủ các tiêu chuẩn khắt khe nhằm đưa về thị trường Việt Nam những sản phẩm chất lượng, hiệu quả và an toàn.


 Hotline: 0989 541 896
Hotline: 0989 541 896